Scoperto un “senso neurobiotico” intestinale nascosto che parla al cervello
Pillole di conoscenza
|
Getting your Trinity Audio player ready...
|
Sembra che l’intestino possa comunicare con il cervello in modi inimmaginabili. Gli scienziati hanno scoperto un “senso neurobiotico”, un sistema a risposta rapida in cui le cellule del colon rilevano le proteine microbiche e inviano istantaneamente messaggi di soppressione dell’appetito al cervello. Questa scoperta rivela come i nostri microbi intestinali potrebbero influenzare non solo la digestione, ma anche il comportamento, l’umore e persino la salute mentale.
Piccole cellule intestinali chiamate neuropodi rilevano una proteina batterica e avvisano il cervello quando abbiamo mangiato a sufficienza. Questo segnale intestino-cervello in tempo reale può aiutare a regolare l’appetito e l’umore e potrebbe spiegare come la dieta e i microbi intestinali influenzano il comportamento.
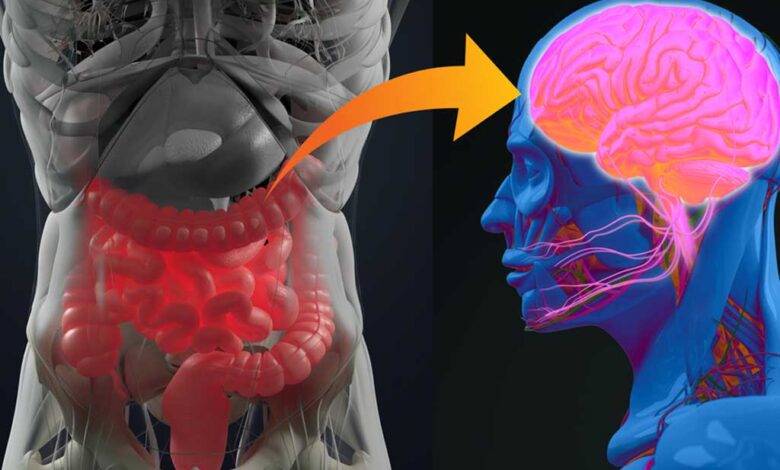
In una svolta che reinventa il modo in cui l’intestino e il cervello comunicano, i ricercatori hanno scoperto quello che chiamano un “senso neurobiotico”, un sistema recentemente identificato che consente al cervello di rispondere in tempo reale ai segnali dei microbi che vivono nel nostro intestino.
La nuova ricerca, guidata dai neuroscienziati Diego Bohórquez, PhD, e M. Maya Kaelberer, PhD, della Duke University School of Medicine, e pubblicata su Nature , si concentra sui neuropodi, minuscole cellule sensoriali che rivestono l’epitelio del colon. Queste cellule rilevano una proteina microbica comune e inviano rapidi messaggi al cervello che aiutano a frenare l’appetito.
Ma questo è solo l’inizio. Il team ritiene che questo senso neurobiotico possa rappresentare una piattaforma più ampia per comprendere come l’intestino percepisce i microbi, influenzando tutto, dalle abitudini alimentari all’umore, e persino come il cervello potrebbe a sua volta modellare il microbioma.
“Eravamo curiosi di sapere se il corpo potesse percepire i modelli microbici in tempo reale e non solo come risposta immunitaria o infiammatoria, ma come una risposta neurale che guida il comportamento in tempo reale”, ha affermato Bohórquez, professore di medicina e neurobiologia presso la Duke University School of Medicine e autore principale dello studio.
L’attore chiave è la flagellina, un’antica proteina presente nei flagelli batterici, una struttura a forma di coda che i batteri usano per nuotare. Quando mangiamo, alcuni batteri intestinali rilasciano flagellina. I neuropodi la rilevano, con l’aiuto di un recettore chiamato TLR5, e inviano un messaggio attraverso il nervo vago, un’importante via di comunicazione tra l’intestino e il cervello.
Il team, supportato dai National Institutes of Health, ha proposto un’idea audace: la flagellina batterica presente nel colon potrebbe indurre i neuropodi a inviare un segnale di soppressione dell’appetito al cervello, un’influenza microbica diretta sul comportamento.
I ricercatori hanno testato questo effetto tenendo i topi a digiuno per tutta la notte, per poi somministrare loro una piccola dose di flagellina direttamente nel colon. I topi hanno mangiato di meno.
Quando i ricercatori hanno ripetuto lo stesso esperimento su topi privi del recettore TLR5, non è cambiato nulla. I topi hanno continuato a mangiare e hanno aumentato di peso, un indizio che il percorso aiuta a regolare l’appetito. I risultati suggeriscono che la flagellina invia un segnale di “ne abbiamo abbastanza” attraverso il TLR5, permettendo all’intestino di dire al cervello che è ora di smettere di mangiare. Senza quel recettore, il messaggio non arriva.
La scoperta rivela l’esistenza di un legame più profondo tra microbi intestinali e comportamento.
Liu WW, Reicher N, Alway E, Rupprecht LE, Weng P, Schaefgen C, Klein ME, Villalobos JA, Puerto-Hernandez C, Kiesling Altún YG, Carbajal A, Aguayo-Guerrero JA, Coss A, Sahasrabudhe A, Anikeeva P, de Araujo A, Bali A, de Lartigue G, Gil-Lievana E, Gutierrez R, Miao EA, Rawls JF, Kaelberer MM, Bohórquez DV. A gut sense for a microbial pattern regulates feeding. Nature. 2025 Jul 23. doi: 10.1038/s41586-025-09301-7. Epub ahead of print. PMID: 40702192.